De scheikunde van het resomeren
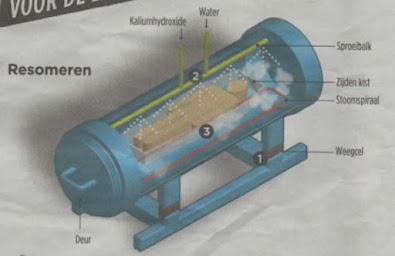
Bron: De Volkskrant 8 januari 2022 Over het algemeen ontdoet men zich in Nederland van lijken door ze te begraven of te verbranden (crematie). Er zijn uiteraard meer mogelijkheden. Bijvoorbeeld worden lijken bewaard, door ze te balsemen en in doeken te wikkelen zoals bij mummies of door ze te bewaren in vloeibare stikstof (-196 o C ) tot de geneeskunde zich zo ver ontwikkeld heeft dat de lijken weer tot leven gebracht kunnen worden (zo hopen de mensen die dat bij zich laten doen). Een techniek die door misdadigers wel eens gebruikt is, is te proberen de lijken op te lossen in zuur en dan via het riool af te voeren. Deze techniek is niet zo goed omdat lijken slechts gedeeltelijk oplossen in zuur. Een betere techniek is het om lijken op te lossen in een oplossing van een sterke base. (Heel in het kort: Een zuur en een base zijn elkaars tegenpolen. Een zuur doet de pH dalen en een base doet de pH stijgen. Een zuur en een base reageren met elkaar en neutraliseren elkaar daarmee). De tec